Бронхиальная астма
Содержание:
Описание:
Бронхиальная астма - это хроническое рецидвирующее воспалительное заболевание органов дыхания, патогенетической сущностью которого является гиперреактивность бронхов, связанная с иммунопатологическими механизмами, а главным клиническим симптомом болезни является приступ удушья вследствие воспалительного отека слизистой оболочки бронхов, бронхоспазма и гиперсекреции слизи.
Для более полного представления про сложность дефиниции проблемы приводим еще одно определение заболевания (из материалов Международного консенсуса по проблемам диагностики и лечения бронхиальной астмы): "Бронхиальная астма представляет сосбой хроническое воспалительное заболевание дыхательных путей, в развитии которого принимают участие множество элементов, включая гладкие мышечные клетки и эозинофилы. У людей с повышенной чувствительностью подобное воспаление вызывает симптомы, обычно связанные с наличием распространенной обструкции дыхательных путей различной степени выраженности, обратимой спонтанно либо под действием проведенного лечения, а так же повышение чувствительности дыхательных путей к различным стимулам".
Гиперреактивность, как специфическая, так и неспецифическая, является главным универсальным патогенетическим признаком бронхиальной астмы, и лежит в основе нестабильности дыхательных путей. Особыми клеточными элементами воспаления при бронхиальной астме являются эозинофилы, глакие мышечные клетки, Т-лимфациты и макрофаги.
Причины возникновения:
В этиологии бронхиальной астмы имеют значение следующие факторы:
1. Наследственность. Большое значение имеют генетические аспекты в вопросе причин развития бронхиальной астмы. В проведенных исследованиях сообщалось о случаях конкордантности, то есть когда оба из однояйцевых близнецов болели бронхиальной астмой. В клинической практике часто встречаются семейные случаи заболеваемости, когда у болеющей астмой матери дети так же заболевают этим недугом. В результате клинико-генеалогического анализа обнаружено, что у 1/3 больных заболевание носит наследственный характер. При наличии акцента на наследственный характер заболевания указывают на атопическую бронзиальную астму. В этом случае, при наличии астмы у одного из родителей, вероятность астмы у ребенка составляет 20—30 %, а если больны оба родителя, эта вероятность достигает 75 %. Было проведено исследование, в рамках которого наблюдали за формированием атопии у новорожденных в семьях фермеров и у монозиготных близнецов показало, что, несмотря на генетическую предрасположенность, развитие заболевания можно предотвратить исключая провоцирующие аллергены и путем коррекции иммунного ответа в период беременности. Норвежскими учеными установлено, что место и время рождения не влияют на формирование аллергических реакций и бронхиальной астмы.
2. Профессиональные факторы. Влияние биологической и минеральной пыли, в том числе деревесной, мучной, хлопковой и т.д., вредных газов и испарений на возникновение респираторных заболеваний исследовалось у 9144 человек в 26 центрах в исследовании ECRHS. Женщины в основном контактировали с биологической пылью, а мужчины в 3—4 раза чаще, чем женщины, — с минеральной пылью, вредными газами и испарениями. При этом выявлено, что хронический кашель с выделением мокроты чаще возникал у лиц, контактировавших с вредными факторами, именно в этой популяции зарегистрированы случаи впервые возникшей бронхиальной астмы. При этом выявлено, что даже при уменьшении контакта с вредным профессиональным фактором, с течением времени неспецифическая гиперреактивность бронхов у лиц с профессиональной астмой не исчезает. Тяжесть профессиональной астмы в основном определяется продолжительностью заболевания и выраженностью симптомов, не зависит от возраста, пола, вредного профессионального фактора, атопии, курения.
3. Экологические факторы. 9-летнее эпидемиологическое исследование ECRHS-II, включившее 6588 здоровых лиц, подвергавшихся в течение указанного периода воздействию ряда неблагоприятных факторов (выхлопные газы, дым, повышенная влажность, вредные испарения и др.), показало, что у 3 % наблюдаемых в конце исследования возникли жалобы, соответствующие поражению дыхательной системы. После статистического анализа демографических, эпидемиологических и клинических данных был сделан вывод, что от 3 до 6 % новых случаев заболевания провоцируются воздействием поллютантов.
4. Питание. Исследования во многих странах, посвященные влиянию характера питания на течение заболевания показали, что лица, употребляющие продукты растительного происхождения, соки, богатые витаминами, клетчаткой, антиоксидантами, имеют незначительную тенденцию к более благоприятному течению бронхиальной астмы. Соответственно употребление продуктов животного происхождения, богатых жирами, белками и рафинированными легкоусвояемыми углеводами, связано с тяжёлым течением заболевания и частыми обострениями.
5. Алкоголь. Согласно исследованию датских ученых, членов Европейского респираторного общества (ERS), умеренное употребление алкоголя снижает риск заболеть астмой. Согласно исследования еженедельное употребление 10-60 мл алкоголя нивелирует шансы "заработать" астму, вдыхая пыльцу цветковых растений, белковые вещества кошек и собак, домашнюю пыль и даже кухонных тараканов. Десять "кубиков" алкоголя - это стандартный зарубежный "дринк", соответствующий бутылке легкого пива или же неполному бокалу вина. При этом совcем непьющие люди, а также личности, злоупотребляющие алкоголем, имеют повышенные шансы развития астмы.
6. Моющие средства. 10-летнее исследование ECRHS в 10 странах Евросоюза показало, что различные моющие средства, в том числе чистящие аэрозоли содержат вещества, провоцирующие астму у взрослых; с применением этих средств связывают около 18 % новых случаев.
7. Микроорганизмы. Долгое время существовало представление о существовании астмы инфекционно-аллергической природы (классификация Адо и Булатова), согласно этой теории в патогенезе бронхиальной астмы учавствуют вирусы, грибки, бактерии.
8. Острый и хронический стресс.
Патогенез:
Патогенетические механизмы бронхиальной астмы до конца не изучены. Если у больного имеется генетическая предрасположенность, то после сенсибилизации организма аллергеном в результате несовершенства контроля Т-лимфоцитов за синтезом реагинов возрастает концентрация иммуноглобулинов класса E. При этом происходит фиксация антител на рецепторах мембран тучных клеток. После контакта с "триггером" просходит высвобождение гистамина, медленно реагирующей субстанции анафилаксии (МРСА), хемотаксического фактора эозинофилов и т.д. Каскад последовательных иммунологических реакций (1 типа - анафилактический, атопический, реагиновый, гиперчувствительность немедленного типа - ГНТ)в конечно митоге приводит к развитию бронхоспазма, а следовательно - к клиническим признакам удушья. Таким образом, действует иммунопатологический "вариант воспаления", то есть при бронхиальной астме аллергическая реакция и воспаление в бронхах неразрывно взаимосвязаны. В патогенезе бронхиальной астмы важную роль играют и другие типы иммунопатологических реакций: тип 3 - иммунокомплексный ( так называемый феномен Артюса), при котором главным фактором, вызывающим бронхоспазм, являются лизосомальные ферменты; тип 4 - клеточный (гиперчувствительность замедленного типа - ГЗТ). С одной стороны, сложный иммунопатологический патогенез заболевания во многом определяет вариабельность (и непредсказуемость, вплоть до многолетних спонтанных ремиссий) характера течения бронхиальной астмы у конкретного больного (в результате смены основного типа иммунопатологической реакции), с другой, - объясняет неэффективность большинства антивоспалительных средств (наиболее же эффективное противовоспалительное действие оказывают глюкокортикоиды, влияющие на все типы иммунопатологических реакций).
На определенных этапах течения бронхиальной астмы, наряду с иммунопатологическими механизмами, определенное значение могут приобретать вторичные нарушения, среди которых важное место занимают нервно-рефлекторные реакции.
Симптомы:
Для клинической картины бронхиальной астмыхарактерны такие симптомы как нарушение дыхания в виде одышки и кашель. Данные симптомы возникают после контакта с аллергеном, что имеет большое значение в диагностике. Так же отмечается сезонная вариабельность симптомов и наличие родственников с бронхиальной астмой или другими атопическими заболеваниями. При сочетании с ринитом симптомы астмы могут либо появляться только в определенное время года, либо присутствовать постоянно с сезонными ухудшениями. У некоторых пациентов сезонное увеличение уровня в воздухе определенных аэроаллергенов (например пыльца Alternaria, берёзы, травы и амброзии) вызывает развитие обострений.
Указанные симптомы могут также развиваться при контакте с неспецифическими веществами (дымом, газами, резкими запахами) или после физической нагрузки 9так называемая астма физического напряжения), могут обостряться в ночные часы и уменьшаться в ответ на базисную терапию.
Наиболее типичным симптомом бронхиальной астмы является приступ удушья. В это время больной сидит в вынужденном положении, наклонившись вперед, держась руками за стол, с приподнятым верхним плечевым поясом, грудная клетка приобретает цилиндрическую форму. Больной делает короткий вдох и без паузы продолжительный мучительный выдох, сопровождаемый дистанционными хрипами. Дыхание происходит с участием вспомогательной мускулатуры грудной клетки, плечевого пояса, брюшного пресса. Межреберные промежутки расширены, втянуты и расположены горизонтально. Перкуторно определяется коробочный легочный звук, смещение вниз нижних границ легких, экскурсия легочных полей едва определяется.
Часто, особенно при затяжных приступах, возникает боль в нижней части грудной клетки, связанная с напряженной работой диафрагмы. Приступу удушья может предшествовать аура приступа, проявляющаяся чиханием, кашлем, ринитом, крапивницей, сам приступ может сопровождаться кашлем с небольшим количеством стекловидной мокроты, также мокрота может отделяться в конце приступа. При аускультации определяется ослабленное дыхание, сухие рассеянные хрипы. Сразу же после кашлевых толчков слышно увеличение количества свистящих хрипов, как в фазе вдоха, так и на выдохе, особенно в задненижних отделах, что связано с секрецией мокроты в просвет бронхов и её пассажем. По мере отхождения мокроты количество хрипов уменьшается и дыхание из ослабленного становится жёстким.
Хрипы могут отсутствовать у больных с тяжелыми обострениями вследствие тяжелого ограничения воздушного потока и вентиляции. В период обострения отмечаются также цианоз, сонливость, затруднения при разговоре, тахикардия. Вздутая грудная клетка является следствием повышенных легочных объёмов — необходимо обеспечивать «расправление» дыхательных путей и раскрытие мелких бронхов. Сочетание гипервентиляции и бронхиальной обструкции значительно увеличивает работу дыхательных мышц.
Между приступами у больных может не наблюдаться никаких признаков болезни. В межприступный период у пациентов чаще всего выявляются свистящие хрипы при аускультации, подтверждающие наличие остаточной бронхиальной обструкции. Иногда (и порой одновременно с выраженной обструкцией бронхов) свистящие хрипы могут отсутствовать или обнаруживаться только во время форсированного выдоха.
Описаны так же случаи бронхиальной астмы, клиническая картина которой характеризуется лишь кашлем. Такой вариант астмы называют кашлевым.Он чаще распространен у детей, наиболее выраженные симптомы обычно отмечаются в ночное время при частом дневном отсутствии симптомов. Важность в диагностике имеет исследование вариабельности показателей функции дыхания или бронхиальной гиперреактивности, а также эозинофилия мокроты. Кашлевой вариант астмы следует различать с эозинофильным бронхитом, при котором отмечаются кашель и эозинофилия мокроты, однако показатели функции дыхания и бронхиальная реактивность остаются в норме.
Бронхиальная астма физического напряжения. У некоторых пациентов единственным триггером приступа является физическая активность. Приступ обычно развивается через 5—10 мин после прекращения нагрузки и редко — во время нагрузки. Пациенты иногда отмечают длительный кашель, который самостоятельно проходит в течение 30—45 мин. Приступы чаще провоцируются бегом, имеет значение при этом вдыхание сухого холодного воздуха. В пользу диагноза бронхиальной астмы говорит прекращение приступа после ингаляции β2-агонистов или предотвращение симптомов благодаря ингаляции β2-агонистами до нагрузки. Основной метод диагностики — тест с 8-минутным бегом.
Лечение:
Для лечения назначают:
Лечение бронхиальной астмы должно быть комплексным и длительным. В качестве терапии используются препараты базисной терапии, воздействующие на механизм заболевания, посредством которых пациенты контролируют астму,а так же симптоматические препараты, влияющие только на гладкую мускулатуру бронхиального дерева и снимающие приступ удушья.
К препаратам симптоматической терапии относят бронходилятаторы:
1. β2-адреномиметики
2. ксантины
К препаратам базисной терапии относят:
1. кортикостероиды, применяемые ингаляционно
2. кромоны
3. антагонисты лейкотриеновых рецепторов
4. моноклональные антитела.
Базисную терапию принимать необходимо, т.к. без это растет потребность в ингаляции бронходилататоров (симптоматических средств). В этом случае и в случае недостаточности дозы базисных препаратов рост потребности в бронходилататорах является признаком неконтролируемого течения заболевания.
Кромоны.
К кромонам относят такие препараты как кромогликат натрия (Интал) и недокромил натрия (Тайлед). Эти средства показаны в качестве базисной терапии бронхиальной астмы с интермиттирующим и легким течением. Кромоны менее сильны по своей эффективности ИГКС. Так как существуют показания для назначения ИГКС уже при легкой степени бронхиальной астмы, кромоны постепенно вытесняются более удобными в использовании ингаляционные глюкокортикостероиды. Не оправдан также переход на кромоны с ИГКС при условии полного контроля над симптомами минимальными дозами ИГКС.
Ингаляционные глюкокортикостероиды.
При астме применяются ингаляционные глюкокортикостероиды, которым не свойственно большинство побочных действиев системных стероидов. При неэффективности ингаляционных кортикостероидов добавляют глюкокортикостероиды для системного применения.
ИГКС — основная группа препаратов для лечения бронхиальной астмы. Ниже представлена классификация ингаляционных глюкокортикостероидов в зависимости от химической структуры:
Негалогенированные:
- циклесонид (Алвеско)
- будесонид (Пульмикорт, Бенакорт)
Хлорированные:
- беклометазона дипропионат (Бекотид, Беклоджет, Кленил, Беклазон Эко, Беклазон Эко Легкое Дыхание)
- мометазона фуроат (Асмонекс)
Фторированные:
- флунизолид (Ингакорт)
- триамценолона ацетонид
- азмокорт
- флутиказона пропионат (Фликсотид)
Ингаляционные глюкокортикостероиды оказывают противовоспалительный эффект, что связано с подавлением деятельности клеток воспаления, уменьшением продукции цитокинов, вмешательством в метаболизм арахидоновой кислоты и синтез простагландинов и лейкотриенов, снижением проницаемости сосудов микроциркуляторного русла, предотвращением прямой миграции и активации клеток воспаления, повышением чувствительности b-рецепторов гладкой мускулатуры. Под воздействием ингаляционных глюкокортикостероидов происходит увеличение синтеза противовоспалительного белка липокортина-1, путем ингибирования интерлейкина-5 увеличивают апоптоз эозинофилов, что приводит к снижению их колическтва, стабилизации клеточных мембран. В отличие от системных глюкокортикостероидов, ИГКС тропны к жировой ткани, имеют короткий период полувыведения, быстро инактивируются, обладают местным (топическим) действием, благодаря чему имеют минимальные системные проявления. Наиболее важное свойство — липофильность, благодаря которому ИГКС накапливаются в дыхательных путях, замедляется их высвобождение из тканей и увеличивается их сродство к глюкокортикоидному рецептору. Легочная биодоступность ИГКС зависит от процента попадания препарата в лёгкие (что определяется типом используемого ингалятора и правильностью техники ингаляции), наличия или отсутствия носителя (лучшие показатели имеют ингаляторы, не содержащие фреон) и от абсорбции препарата в дыхательных путях.
До недавнего времени главенствующией концепцией назначения ИГКС была концепция ступенчатого подхода, что означает что при более тяжелых формах заболевания назначаются более высокие дозы ИГКС.
В приведенной таблице предствалены эквивалентные дозы ИГКС, мкг.
Международное название Низкие дозы Средние дозы Высокие дозы
Беклометазона дипропионат 200—500 500—1000 1000
Будесонид 200—400 400—800 800
Флунизолид 500—1000 1000—2000 2000
Флутиказона пропионат 100—250 250—500 500
Триамсинолона ацетонид 400—1000 1000—2000 2000
На сегоднешний день ингаляционные глюкокортикоиды являются препаратом первого выбора и базисом в лечении бронхиальной астмы не смотря на степень ее выраженности. Согласно концепции ступенчатого подхода: «Чем выше степень тяжести течения БА, тем большие дозы ингаляционных стероидов следует применять». В ряде исследований показано, что у пациентов, начавших лечение ИГКС не позже 2 лет от начала заболевания, отмечены существенные преимущества в улучшении контроля над симптомами астмы, по сравнению с начавшими такую терапию по прошествии 5 лет и более.
Кроме "чистых" глюкокортикоидов ингаляторы могут содержать комбинации препаратов.
Симбикорт Турбухалер.
Существуют фиксированные комбинации ИГКС и пролонгированных β2-адреномиметиков, сочетающие в себе средство базисной терапии и симптоматическое средство. Согласно глобальной стратегии GINA, фиксированные комбинации являются наиболее эффективными средствами базисной терапии бронхиальной астмы, так как позволяют снимать приступ и одновременно являются лечебным средством. Наибольшей популярностью пользуются две такие фиксированные комбинации:
- салметерол + флутиказон (Тевакомб или Серетид 25/50, 25/125 и 25/250 мкг/доза, Серетид Мультидиск 50/100, 50/250 и 50/500 мкг/доза)
- формотерол + будесонид (Симбикорт Турбухалер 4,5/80 и 4,5/160 мкг/доза).
Серетид «Мультидиск».
В состав препарата Серетид входит салметерол в дозе 25 мкг/доза в дозированном аэрозольном ингаляторе и 50 мгк/доза в аппарате «Мультидиск». Максимально-допустимая суточная доза салметерола — 100 мкг, то есть максимальная кратность применения Серетида составляет 2 вдоха 2 раза для дозированного ингалятора и 1 вдох 2 раза для приспособления «Мультидиск». Ингалятор Симбикорт показан в том случае, если необходимо увеличить терапевтическую дозу. Он содержит формотерол, максимально-допустимая суточная доза которого составляет 24 мкг, делает возможным ингалироваться Симбикортом до 8 раз в сутки. В исследовании SMART выявлен риск, связанный с применением салметерола по сравнению с плацебо. Кроме того, бесспорным преимуществом формотерола является и то, что он начинает действовать сразу после ингаляции, а не через 2 часа, как салметерол.
Концепция гибкого дозирования препарата.
Недостатком концепции ступенчатого подхода является то, что он чётко не подразумевает достижение цели (снижение частоты приступов, ночных симптомов, снижение частоты обострений, облегчение физической активности), а просто диктует определенную дозу базисной терапии при той или иной степени выраженности симптомокомплекса. Исследования в Европе и Америке показали, что уровень контроля над симптомами астмы даже в странах с развитой системой здравоохранения невысок. Концепция гибкого дозирования проверялась в исследованиях с препаратом симбикорт (будесонид 80 или 160 мкг + формотерол 4,5 мкг). Безопасно ингалироваться симбикортом до 8 раз в сутки, поэтому если возникает необходимость увеличить дозу ИГКС, можно просто увеличить число ингаляций препарата. Ингаляция симбикорта обеспечивает незамедлительный бронхолитический эффект и увеличение дозы ИГКС. Пациент после обучения может сам регулировать свою дозу ИГКС, применяя симбикорт то чаще, то реже — от 1 до 8 раз в день. Таким образом концепция гибкого дозирования заключается в том, что пациент начинает лечение со средних доз симбикорта и затем, исходя из собственного самочувствия, повышает или снижает дозу с помощью одного и того же ингалятора.
Авторы концепции гибкого дозирования выдвигают следующие тезисы:
- Гибкое дозирование более удобно для больного.
- Можно уменьшить общую дозу ИГКС, так как после улучшения состояния больной быстро уменьшает число ингаляций, а значит, можно снизить риск НЛР при использовании ИГКС.
- Снижается общая стоимость лечения.
- Снижается количество обострений, поскольку временное увеличение дозы симбикорта позволяет предотвратить их развитие.
Проведённые рандомизированные клинические исследования, посвященные гибкому дозированию симбикорта, свидетельствуют, что применение гибкого дозирования позволяет быстрее достичь контроля над симптомами астмы по сравнению с фиксированными дозами препаратов, существенно снизить частоту обострений астмы, уменьшить материальные затраты на лечение. В ряде исследований сравнивали симбикорт в режиме гибкого дозирования и серетид, лучшие результаты принадлежат симбикорту. Так же теоретически для гибкого дозирования могут быть использованы и другие препараты, но в настоящее время не имеется данных независимых многоцентровых рандомизированых исследований, об эффективности их применения.
Глюкокортикостероиды для системного применения.
Глюкокортикостероиды для системного применения или системные глюкокортикостероиды (СГКС) могут применяться внутривенно небольшими дозами при обострениях астмы, перорально короткими курсами или длительно. Значительно реже используется внутривенное введение больших доз СГКС (пульс-терапия).
СГКС могут применяться длительно при неэффективности ингаляционных глюкокортикостероидов. При этом бронхиальная астма характеризуется как стероидозависимая и присваивается тяжелое течение заболевания.
При применении системных глюкокортикоидов возникают побочные явления: нарушение минерализации костей, повышение артериального давления, сахарный диабет, подавление функциональной активности гипоталамо-гипофизарно-надпочечниковой системы, катаракту, глаукому, ожирение, истончение кожи с образованием стрий и повышенной капиллярной проницаемостью, мышечную слабость. Поэтому одновременно с назначением системных глюкокортикостероидов начинают терапию по предупреждению остеопороза. Для перорального применения используются преднизон, преднизолон, метилпреднизолон (Метипред), гидрокортизон. Эти препараты обладают меньшими, чем другие ГКС, минералокортикоидной активностью, нерезко выраженным действием на поперечнополосатую мускулатуру и относительно коротким периодом полувыведения. Длительный прием препарата триамцинолон (Полькортолон) чреват побочными эффектами, такими как развитие мышечной дистрофии, похудание, слабости, поражения желудочно-кишечного тракта. Дексаметазон не применяется длительно перорально при бронхиальной астме из-за выраженного подавления функции коры надпочечников, способности задерживать жидкости и низкого сродства к легочным рецепторам ГКС.
Важным является установление причин, приведших к необходимости данного вида лечения. Вот перечень наиболее важных из них:
1. Ятрогенные
- неназначение ИГКС
- недооценка степени тяжести на предшествующих этапах
- попытка контроля воспаления в период обострения низкими дозами ГКС, что приводит к назначению системных ГКС на длительный срок
- применение неселективных и слабоселективных β-блокаторов (пропранолол, атенолол)
- неправильный подбор системы доставки для ИГКС
- некорректный диагноз бронхиальной астмы, где респираторные симптомы являются следствием другой патологии (системные васкулиты, системная склеродермия, дерматомиозит, бронхолегочный аспергиллез, гастроэзофагеальная рефлюксная болезнь, истерия и т. д.)
2. Низкий комплайнс.
3. Продолжающаяся экспозиция аллергенов.
В 5 % от общего количества случаев назначения глюкокортикостероидов имеет место стероидорезистентность, то есть резистентность стероидных рецепторов к стероидным препаратам.
В связи с этим выделяют два типа пациентов:
1. Ко 2-ому типу пациентов относят больных, для которых характерна истинная стероидная резистентность. Пациенты этой группы не имеют побочных эффектов при длительном приеме высоких доз системных глюкокортикоидов.
2. К 1-ой группе пациентов относят больных с приобретенной резистентностью, которые имеют побочные эффекты от приема системных стероидов. Для преодоления такой резистентности назначают повышенные дозы глюкокортикостероидов, и назначают препараты, которые имеют аддиктивный эффект.
При снижении дозы СГКС врач должен правильно оценить клиническую картину заболевания, предположить возможные причины стероидозависимости и назначить максимальные дозы высокоэффективных ИГКС. Обязателен контроль функций дыхания, ежедневная пикфлоуметрия и учет приема β2-агонистов по потребности. Следует снижать СГКС постепенно на фоне приема максимальных доз ИГКС, например уменьшая дозу не ранее чем каждые 3—4 нед, во избежание развития осложнений. Целесообразно при каждом уменьшении дозы проводить анализ крови, в котором обращают внимание на нарастание СОЭ и эозинофилии, что может свидетельствовать о проявлении системного заболевания, в том числе васкулита, исследовать базальный уровень кортизола, так как после прекращения длительной терапии подавляющими дозами СГКС возможно развитие надпочечниковой недостаточности. Снижать дозы ИГКС допускается только после полной отмены СГКС.
Антилейкотриеновые препараты.
В настоящее время известны следующие антагонисты лейкотриенов:
- зафирлукаст (Аколат)
- монтелукаст (Сингуляр)
- пранлукаст
Механизм действия препаратов этой группы заключается в быстром устранении базального тонуса дыхательных путей, который создается лейкотриенами вследствие хронической активации 5-липоксигеназной ферментной системы. Благодаря этому широкое применение эта группа препаратов получила при аспириновой бронхиальной астме, в патогенезе которой имеет место усиленная активация 5-липоксигеназной системы и повышенная чувствительность рецепторов к лейкотриенам. Антагонисты лейкотриенов особенно эффективны при этой форме астмы, терапия которой нередко вызывает трудности.
Зафирлукаст способствует достоверному улучшению по сравнению с плацебо показателей ОФВ1, ПСВ и устранению симптомов при добавлении к ИГКС.
Применение монтелукаста в сочетании с ИГКС и пролонгированными β2-агонистами, особенно при наличии аллергического ринита, позволяет быстрее улучшить контроль над заболеванием, снизить дозу ИГКС.
Недавно проведенное в Великобритании исследование показало, что антагонисты рецепторов к лейкотриенам также эффективны, как и ингаляторы, содержащие глюкортикостероиды. Антилейкотриеновые препараты, такие как Монтелукаст (Сингуляр) и Зафирлукаст (Аколат), подвергнулись рандомизированному контролируемому исследованию в группе из 650 больных бронхиальной астмой в течении 24 месяцев. Результаты исследования опубликованы в New England Journal of Medicine. Авторы исследования полагают, что применение антилейкотриеновых препаратов возможно у 4-х из 5 больных бронхиальной астмой, в особенности у тех пациентов, которые не хотят применять ГКС-ингаляторы из-за их побочных эффектов или из-за стероидофобии.
Моноклональные антитела.
Сравнительно недавно был разработан новый препарат — Омализумаб (фирмой Novartis производится под торговым названием Ксолар), представляющий концентрат антител к IgE. Данный препарат связывает свободный иммуноглобулин E в крови, вызывая тем самым ограничение дегрануляции и выходу биологически активных веществ, которые запускают ранние аллергические реакции.
Ксолар может применяться у лиц старше 12 лет со средней и тяжелой формами персистирующей бронхиальной астмы, с аллергической астмой, триггерами которой являются круглогодичные аллергены, подтвержденной кожными тестами или исследованием специфического IgE.
Препарат исследован в Study 1 и Study 2 с общим количеством пациентов 1071 в возрасте от 12 до 76 лет, получавших беклометазона дипропионат, разделенных на 2 группы (получавших подкожно ксолар или плацебо). Добавление Ксолара к имеющейся терапии ИГКС позволяют значительно снизить дозу ИГКС, сохранив при этом контроль над симптомами астмы. По данным Study 3, где в качестве ИГКС был выбран флутиказона пропионат, разрешалось добавлять к терапии длительнодействующие бронходилататоры, и в котором принимали участие более тяжелые пациенты, разницы между ксоларом и плацебо выявлено не было.
β2-адреномиметики длительного действия.
К β2-адреномиметикам длительного действия в настоящее время относят:
- формотерол (Оксис, Форадил)
- салметерол (Серевент)
- индакатерол
Форадил — формотерол фирмы Новартис.
По данным исследования SMART определяется небольшое, но статистически значимое увеличение смертельных случаев в группе салметерола, связанных с респираторными осложнениями (24 по сравнению с 11 в группе плацебо; относительный риск [RR]=2,16; 95 % доверительный интервал [CI] составил 1,06—4,41), случаев смерти, обусловленных астмой (13 по сравнению с 3 в группе плацебо; RR=4,37; 95 % CI составил 1,25—15,34), а также комбинированных случаев смерти, связанных с астмой (37 по сравнению с 22 в группе плацебо; RR=1,71; 95 % CI составил 1,01—2,89).При этом ряд исследований, в которых участвовал формотерол, демонстрировали безопасность формотерола в суточной дозе до 24 мкг как в отношении респираторных, так и сердечно-сосудистых осложнений.В исследовании FACET, где использовался Оксис, выяснилось, что добавление формотерола снижает частоту легких и тяжелых приступов бронхиальной астмы как к низком дозам будесонида (на 26 % для тяжелых приступов и на 40 % для легких приступов), так и к высоким (высокие дозы будесонида без формотерола снижали частоту тяжелых приступов на 49 % и легких на 39 %, с формотеролом — соответственно на 63 и 62 %).
β2-адреномиметики короткого действия .
Ассортимент β2-адреномиметиков короткого действия представлен следующими препаратами:
- фенотерол (беротек)
- сальбутамол (вентолин)
- тербуталин (бриканил)
Являются наиболее эффективными из существующих бронхолитиков, и поэтому им принадлежит первое место среди препаратов купирования острых симптомов астмы в любом возрасте. Предпочтителен ингаляционный путь введения, так как он обеспечивает более быстрый эффект при более низкой дозе и меньших побочных эффектах. Ингаляция β2-агониста обеспечивает выраженную защиту от бронхоспазма на фоне физической нагрузки и других провоцирующих факторов, в течение 0,5-2 ч.
Ксантины.
К группе ксантинов относят эуфиллин, используемый для экстренного купирования приступа и теофиллин с длительным действием, принимаемый перорально. Эти препараты использовались до β2-адреномиметиков и в некоторых ситуациях используются в настоящее время. Показана эффективность теофиллина в качестве монотерапии и терапии, назначаемой в дополнение к ИГКС или даже СГКС у детей в возрасте старше 5 лет. Он эффективнее плацебо, устраняет дневные и ночные симптомы и улучшает функцию легких, а поддерживающая терапия им обеспечивает защитный эффект при нагрузке. Добавление теофиллина у детей с тяжелой астмой, позволяет улучшить контроль и снизить дозу ГКС. Предпочтение отдается препаратам замедленного высвобождения с изученным всасыванием и полной биодоступностью вне зависимости от приема пищи (Теопек, Теотард). В настоящее время терапия производными ксантинов имеет вспомогательное значение, как метод купирования приступов при малой эффективности, или отсутствии других групп препаратов.
Препараты других групп.
Отхаркивающие препараты улучшают отделение мокроты. Они, особенно при применении их через небулайзер, снижают вязкость мокроты, способствуют разрыхлению слизистых пробок и замедлению их образования. Для усиления эффекта при вязкой мокроте рекомендуется прием жидкости в объёме 3—4 л жидкости в сутки. Имеет эффект после приема отхаркивающих препаратов через небулайзер проведение постурального дренажа, перкуссионного и вибрационного массажа грудной клетки. В качестве основных отхаркивающи препаратов используют препараты йода, гвайфенезин, N-ацетилцистеин, амброксол.
При осложнении астмы бактериальными инфекциями показано применение антибактериальных средств, чаще всего это синуситы, бронхит и пневмония. У детей до 5 лет астма чаще осложняется вирусной инфекцией, в этих случаях антибиотики не назначают. В возрасте от 5 до 30 лет может быть микоплазменная пневмония, при этом назначают тетрациклин или эритромицин. Наиболее распространенный возбудитель пневмонии у лиц старше 30 лет — Streptococcus pneumoniae, против которого эффективны пенициллины и цефалоспорины. При подозрении на пневмонию обязательно проводят микроскопию мазка мокроты, окрашенного по Граму, и её посев.
Аллергенспецифическая иммунотерапия (АСИТ).
Один из традиционных способов лечения бронхиальной астмы, влияющий на её иммунологическую природу. АСИТ обладает таким терапевтическим действием, которое распространяется на все этапы аллергического процесса и отсутствует у известных фармакологических препаратов. Действие АСИТ охватывает собственно иммунологическую фазу и приводит к переключению иммунного ответа с Th2-типа на Th1-тип, тормозит как раннюю, так и позднюю фазы IgE-опосредованной аллергической реакции, угнетает клеточную картину аллергического воспаления и неспецифическую тканевую гиперреактивность. Проводится пациентам от 5 до 50 лет при экзогенной бронхиальной астме. Через определенные промежутки времени вводят подкожно аллерген, постепенно увеличивая дозу. Длительность проведения курса — не менее 3 месяцев. Наиболее эффективна аллергенспецифическая иммунотерапия с аллергенами домашних клещей, тогда как АСИТ с аллергенами домашней пыли малоэффективна. Допускается одновременное использование не более 3 видов аллергенов, вводимых с интервалом не менее 30 минут.
Кроме аллергенов для лечения бронхиальной астмы также используются введения гистаглобулина. В течение последнего десятилетия вводятся в практику назальный и сублингвальный способы введения аллергенов. К настоящему времени в России зарегистрировано несколько видов оральных аллергенов для проведения АСИТ (пыльца деревьев, грибы, клещи).
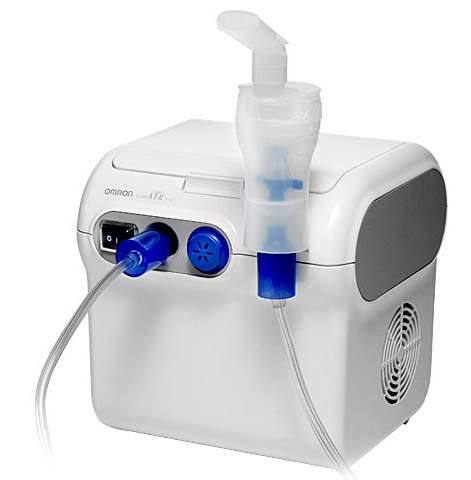
Использование небулайзеров.
При бронхиальной астме важным моментом в осуществлении успешной терапии является доставка лекарственного препарата к очагу воспаления в бронхах, чтобы добиться этого результата нужно получить аэрозоль заданной дисперсности. Для этого применяются специальные аппараты, называемые небулайзерами. Небулайзер редставляет собой ингалятор, производящий аэрозоль с частицами заданного размера. Общий принцип работы аппарата состоит в создании мелкодисперсного аэрозоля введённого в него вещества, который за счёт малых размеров частиц проникнет глубоко в мелкие бронхи, которые преимущественно и страдают от обструкции.
В России наиболее распространены 2 типа небулайзеров — ультразвуковые и компрессорные. Каждый из них имеет как свои достоинства, так и недостатки.
Ультразвуковые, более компактные и малошумные, пригодны для ношения с собой, но с их помощью нельзя вводить масляные растворы и суспензии. Компрессорные за счёт воздушного насоса относительно велики, они требуют стационарного питания от сети переменного тока, за счёт работы того же компрессора довольно шумные, но они обладают немаловажным достоинством, с их помощью можно вводить суспензии и масляные растворы, и они примерно на 40—50 % дешевле аналогичных ультразвуковых моделей.
Устранение факторов риска.
Устранение факторов риска позволяет значительно улучшить течение заболевания. У пациентов с аллергической астмой в первую очередь имеет значение устранение аллергена. Имеются данные, что в городских районах у детей с атопической бронхиальной астмой индивидуальные комплексные мероприятия по удалению аллергенов в домах привели к снижению болезненности бронхиальной астмой.
Домашние клещи живут и размножаются в различных частях дома, поэтому полное их уничтожение невозможно. В одном из исследований показано, что использование чехлов для матрацев позволило несколько уменьшить бронхиальную гиперреактивность у детей. Использование чехлов, удаление пыли и уничтожение очагов обитания клещей показало уменьшение частоты симптомов в популяциях детей в детских домах.
Домашние животные. При наличии повышенной реактивности к шерсти животных следует удалить животных из дома, однако полностью избежать контакта с аллергенами животных невозможно. Аллергены проникают во многие места, в том числе в школы, транспорт и здания, в которых никогда не содержали животных.
Курение. Пассивное курение увеличивает частоту и тяжесть симптомов у детей, поэтому необходимо полностью исключить курение в комнатах, где бывают дети. Помимо увеличения выраженности симптомов астмы и ухудшения функции легких в отдаленном периоде, активное курение сопровождается снижением эффективности ИГКС, поэтому всем курящим пациентам следует настоятельно советовать бросить курить.
Грипп и другие инфекции. Необходимо проводить по возможности ежегодную вакцинацию против гриппа. Инактивированные гриппозные вакцины редко осложняются побочными эффектами и обычно безопасны у лиц с астмой старше 3 лет, даже при трудно поддающейся лечению астме. Больным следует обезопасить себя и от других инфекций (риниты, синуситы), особенно в холодное время года.
Лекарственные препараты. Больным с аспириновой астмой противопоказано применение аспирина и НПВП. Также нежелателен прием β-блокаторов, особенно неселективных.
Существует так же специальная гимнастика для больных бронхиальной астмой. Этот метод называют методом Бутейко.
Сторонниками данного метода считается, что одна из причин, ведущих к развитию и усугублению симптомов бронхиальной астмы является снижение альвеолярной вентиляции углекислого газа. Основной задачей при лечении бронхиальной астмы с помощью дыхательной гимнастики Бутейко является постепенное повышение процентного содержания углекислого газа в воздухе лёгких, что позволяет за очень короткий срок уменьшить гиперсекрецию и отёк слизистой оболочки бронхов, снизить повышенный тонус гладких мышц стенки бронхов и тем самым устранить клинические проявления болезни. Метод включает применение дыхательных упражнений, направленных на уменьшение альвеолярной гипервентиляции и/или дозированную физическую нагрузку. Во время дыхательных упражнений пациенту предлагают с помощью различных дыхательных техник постепенно уменьшить глубину вдоха до нормы.
Спелеотерапия (греч. speleon — пещера) — метод лечения длительным пребыванием в условиях своеобразного микроклимата естественных карстовых пещер, гротов, соляных копей, искусственно пройденных горных выработок металлических, соляных и калийных рудников.
Галотерапия (греч. hals — соль) метод лечения пребыванием в искусственно созданном микроклимате соляных пещер, где основным действующим фактором является высокодисперсный сухой солевой аэрозоль (галоаэрозоль). Лечение в соляных пещерах широко применяют как в курортных, так и городских медицинских центрах. Аэрозоли солей тормозят размножение микрофлоры дыхательных путей, предотвращая развитие воспалительного процесса. Адаптация организма к специфическому микроклимату спелеокамеры сопровождается активацией симпатико-адреналовой системы, усилением выработки гормонов эндокринными органами. Увеличивается количество фагоцитирующих макрофагов и Т-лимфоцитов, уменьшается содержание иммуноглобулинов A, G и E, повышается лизоцимная активность сыворотки крови. У пациентов с бронхиальной астмой галотерапия способствует удлинению периода ремиссии и переходу пациента на более низкую степень тяжести, что влечёт за собой и возможность перехода к меньшим дозам и более щадящим средствам базисной медикаментозной терапии.
Профилактика:
Бронхиальная астма- это заболевание, относящееся к тем, которые могут быть предотвращены своевременными и правильно спланированными мерами профилактики. Нужно отметить, что профилактика астмы зачастую оказывается гораздо эффективнее ее лечения. Именно поэтому профилактике астмы нужно уделить самое серьезное внимание.
Исходя из патогенетических аспектов развития астмы, определены методы профилактики астмы: предупреждение развития аллергии и профилактика хронических инфекций дыхательных путей. Профилактика астмы проводится в несколько этапов. В связи с этим различаем первичную, вторичную и третичную профилактику бронхиальной астмы.
Первичная профилактика астмы.
Предусматривает меры по предупреждению астмы у здоровых людей. Основное направление первичной профилактики астмы заключается в предупреждении развития аллергии и хронических болезней дыхательных путей (например, хронический бронхит). Меры первичной профилактики астмы несколько различаются у детей и взрослых.
Первичная профилактика астмы у детей. Наиболее частой формой астмы у детей является атопическая астма, которая напрямую связана с другими формами аллергии. При этом в развитии аллергии у детей основную роль играет неправильное питание в первые годы жизни и неблагоприятные условия жизни. Профилактические меры астмы (и аллергии) у детей включают:
• Грудное вскармливание новорожденных и детей первого года жизни. Роль грудного вскармливания, как меры профилактики астмы и других видом аллергических болезней доказана многочисленными клиническими исследованиями. Грудное молоко благоприятно влияет на развитие иммунной системы организма и способствует формированию нормальной микрофлоры кишечника.
• Своевременное введение вспомогательного питания также является мерой профилактики астмы и аллергии. Современные рекомендации по кормлению детей первого года жизни предусматривают введение вспомогательного питания не ранее чем на 6 месяце первого года жизни. При этом категорически запрещается давать детям такие высокоаллергенные продукты как пчелиный мед, шоколад, куриные яйца, орехи, цитрусовые и пр.
• Исключение неблагоприятных условий в окружении ребенка. Показано, что дети, контактирующие с табачным дымом или раздражающими химическими веществами, гораздо чаще страдают аллергией и чаще заболевают бронхиальной астмой.
• Необходимо проводить профилактику и раннее лечение хронических заболеваний дыхательных органов у детей - бронхита, синуситов, тонзиллита, аденоидов.
Первичная профилактика астмы у взрослых. У взрослых наиболее распространенной причиной бронхиальной астмы, как уже упоминалось выше, являются хронические заболевания дыхательных путей (такие как хронический бронхит) и длительный контакт с раздражающими веществами (табачный дым, химические вещества на месте работы). Ввиду этого методы профилактики бронхиальной астмы у взрослых сводятся к устранению раздражающих факторов и лечению хронических болезней дыхательных органов.
Вторичная профилактика бронхиальной астмы.
Вторичная профилактика астмы включает меры по профилактике болезни у сенсибилизированных лиц или у пациентов на стадии предастмы, но еще не болеющих астмой. Категория пациентов для проведения вторичной профилактики астмы подбирается по следующим критериям:
• Лица, родственники которых уже болеют бронхиальной астмой;
• Наличие различных аллергических болезней (пищевая аллергия, атопический дерматит, аллергический ринит, экзема и пр.);
• Сенсибилизация доказанная при помощи иммунологических методов исследования.
В целях вторичной профилактики бронхиальной астмы у этой группы лиц проводится профилактическое лечение противоаллергическими препаратами. Также могут быть использованы методы по десенсибилизации.
Третичная профилактика астмы.
Пациетам, болеющим бронхиальной астмой, показана третичная профилактика. Третичная профилактика астмы применяется для уменьшения тяжести течения и предупреждения обострений болезни. Основной метод профилактики астмы на этом этапе заключается в исключении контакта пациента с аллергеном, вызывающим приступ астмы (элиминационный режим).
Для качественного проведения элиминационного режима необходимо знать, какой именно аллерген (или группа аллергенов) вызывают приступы астмы у больного. Наиболее распространенными аллергенами являются домашняя пыль, тараканы, микроклещи, шерсть домашних животных, плесневые грибки, некоторые виды пищи, пыльца растений.
Для предотвращения контакта организма больного с этими аллергенами необходимо соблюдать определенные санитарно-гигиенические правила:
• В помещении, в котором проживает больной необходимо проводить регулярную влажную уборку (1-2 раза в неделю), сам больной на время уборки должен покинуть помещение;
• Из помещения, в котором проживает больной астмой должны быть удалены все ковры и мягкая мебель, а также другие предметы, в которых может накапливаться пыль. Также из комнаты больного следует унести комнатные растения;
• Постельное белье больного нужно стирать каждую неделю в горячей воде (60 ̊С) с хозяйственным мылом;
• Использование специальных чехлов, которые не дают проникнуть пыли, для подушек и матрацев;
• Исключение контакта с домашними животными;
• Целесообразно провести меры по борьбе с тараканами и другими насекомыми;
• Из пищевого рациона больного следует исключить все продукты вызывающие аллергию.
Правильно спланированные и выполненные меры по профилактике бронхиальной астмы являются эффективным средством предотвращения и лечения этой болезни. Современная медицинская практика показывают, что правильное проведение мер профилактики астмы зачастую достаточно для излечения болезни либо для значительного уменьшения потребности больного в противоастматических лекарствах.